3 Газовые смеси
3.81 Определить массовый и объемный составы смеси водорода с азотом, если газовая постоянная ее равна R=922 Дж/(кг·К). Определить также парциальные давления компонентов, если абсолютное давление смеси р=0,2 МПа.
Скачать файл (банки РФ) 150 RUB3.82 Смесь идеальных газов состоит из 15 кг СО2, 12 кг N2 и 3 кг О2. Объем смеси в начальном состоянии V1=20 м³, а давление р1=0,1 МПа. В результате адиабатного сжатия температура смеси возрастает до t2=327 ºC. Определить температуру смеси в начальном состоянии, объем и давление смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB3.83 Смесь идеальных газов задана объемными долями: rN2=0,6, rCO2=0,2 и rO2=0,2. Общая масса смеси М=10 кг. Объем смеси в начальном состоянии V1=4 м³, температура t1=387 ºC. В результате адиабатного расширения смеси ее давление уменьшается до значения р2=0,1 МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB3.84 В баллоне емкостью V при температуре t и давлении p содержится газовая смесь, объемный состав которой следующий: RO2, RN2 и RCO2.
Определить массу газа. Исходные данные приведены в табл. 1 и 2.
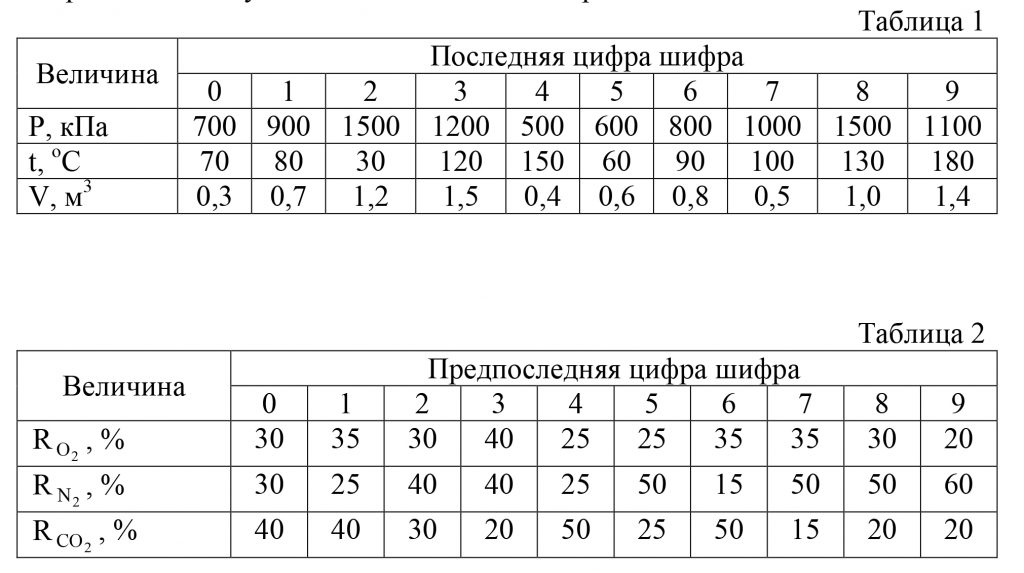
Выбрать вариант задачи
ВУЗ: МГУПП
3.85 Смесь идеальных газов заданного массового состава занимает объем V при постоянном абсолютном давлении p и температуре t. Требуется определить газовую постоянную смеси, среднюю молекулярную массу, массу смеси, объемный состав смеси, а также среднюю мольную, объемную и массовую теплоемкости смеси (при p=const) для интервала температур 0-t.
| Номер
варианта |
Массовый состав смеси, % | V, м3 | р, МПа | t, ºC | |||
| CO2 | H2O | N2 | O2 | ||||
| 0 | 18 | 1 | 65 | 16 | 2 | 1,0 | 200 |
Варианты задачи: 1, 2, 3, 4, 5, 6, 7, 8, 9.
ВУЗ: МИИТ
Все задачи из: Драбкина Е.В. Основы теплотехники МИИТ 2012
3.86 Анализ продуктов сгорания топлива показал их следующий объемный состав: rCO2 = 12,2 %; rO2 = 7,1 %; rCO = 0,4 %; rN2 = 80,3 %. Определить массовый состав входящих в смесь газов.
Скачать файл (банки РФ) 150 RUB3.87 Для сжигания в двигателе внутреннего сгорания водорода в количестве 1 кг требуется 34,8 кг воздуха. Абсолютное давление смеси в конце сжатия р=1,5 МПа. Молярная масса воздуха μв=28,97 кг/кмоль. Определить массовые и объемные доли, парциальные давления водорода и воздуха в горючей смеси, а также отношение их парциальных объемов.
Скачать файл (банки РФ) 150 RUB3.88 Смесь идеальных газов состоит из 6 кг СО2, 4 кг О2 и 10 кг N2. Определить газовую постоянную смеси, молярную массу смеси и массовую изобарную теплоемкость смеси.
Скачать файл (банки РФ) 150 RUBЗадачник: Бухмиров В.В. Теоретические основы теплотехники ИГЭУ 2013.pdf
3.89 Смесь идеальных газов состоит из 30 кг СО2, 24 кг N2 и 6 кг О2. В начальном состоянии объем смеси V1=1,7 м³ и температура t1=330 °С. В результате адиабатного расширения температура газа уменьшается до t2=10 °С. Определить давление смеси в начальном состоянии, объем и давление в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ- и Ts-диаграммах.
Скачать файл (банки РФ) 200 RUB3.90 Для заданного состава (табл. 1.2) сухих продуктов сгорания топлива (не содержащих водяные пары) найти кажущуюся молекулярную массу и газовую постоянную, парциальные давления каждого газа, а также удельный объем и плотность смеси при давлении pатм и температуре t.
Таблица 1.2 — Исходные данные
| Вариант | ратм, кПа | t, ºС | состав по объему, % | ||
| СО2 | О2 | N2 | |||
| 0 | 98 | 500 | 12,3 | 7,2 | 80,5 |
Варианты задачи: 1, 2, 3, 4, 5, 6, 7, 8, 9.
ВУЗ: ДВГУПС






















