3 Газовые смеси
3.51 В резервуаре емкостью 10 м³ под давлением 1,6 бар находится газовая смесь, состоящая из 8 кг азота, 6 кг кислорода и некоторого количества углекислоты; температура смеси 27ºС. Определить количество углекислоты, парциальные давления компонентов, объемный состав смеси, среднюю молярную массу и газовую постоянную.
Скачать файл (банки РФ) 200 RUBВсе задачи из: Сборник задач по термодинамике и теплопередаче Москва 1972
3.52 Смесь, состоящая из СО2 и СО, задана массовыми долями (gСО2 и gCO). Имея начальные параметры – давление р1=0,5 МПа и температуру t1=27 ºС, смесь расширяется при постоянном давлении до объема V2=ρV1.
Определить газовую постоянную смеси, ее начальный объем V1, параметры смеси в состоянии 2, изменение внутренней энергии, энтальпии, энтропии, теплоту и работу расширения в процессе 1-2, если масса смеси m.
Таблица 1 – Исходные данные
| Вариант | gСО2 | gСО | m, кг | ρ=V2/V1 |
| 21 | 0,2 | 0,8 | 4 | 4,5 |
Указание. Теплоемкости газов CO2 и CO принять зависящими от температуры. Их численные значения выбрать из приложения 2.
Скачать файл (банки РФ) 200 RUBВсе задачи из: Балахонцев Е.В. Верес А.А. Теплотехника
3.53 Задан объемный состав газовой смеси: rCH4, rCO2, rCO. Определить массовый и мольный составы смеси, кажущуюся молекулярную массу, газовую постоянную, удельный объем и плотность смеси при давлении смеси p и температуре смеси t. Определить также массовую, объемную и мольную теплоемкость смеси. При этом считать теплоемкость не зависящей от температуры, а мольные теплоемкости компонентов соответственно равны:
(μср)СН4=37,7 кДж/(кмоль·К);
(μср)СО2=37,7 кДж/(кмоль·К);
(μср)СО=29,3 кДж/(кмоль·К);
Массовая с и объемная с′ теплоемкости связаны с мольной соответственно соотношениями:
с=(μср)/μ, кДж/кг;
с′=(μср)/22,4, кДж/м³.
Данные для расчета принять по табл. 1.1.
Таблица 1.1 – Данные к задаче №1
| Вариант | rCH4 | rCO2 | rCO | р, МПа | t, ºС |
| 1 | 0,10 | 0,60 | 0,30 | 0,10 | 0 |
Варианты задачи: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20.
ВУЗ: СибАДИ
Все задачи из: Ненишев А.С. Иванов А.Л. Теплотехника СибАДИ 2009
3.54 Определение основных параметров газовой смеси в состояниях 1 и 2
1 кг газовой смеси заданного состава в % от объёма смеси совершает термодинамические процессы от состояния от 1 до состояния 2 с показателями n1=0; n2; n3=1; n4; n5=k; n6. Объём газовой смеси во всех процессах изменяется в ε=V2/V1 раз. Данная смесь обладает свойствами идеального газа. Начальное давление газовой смеси р1, МПа; начальная температура t1, ºС.
Определить основные параметры газовой смеси в состоянии 1 и в состоянии 2, а также изменение внутренней энергии (Δu), энтальпии (Δi), энтропии (Δs), удельную работу, удельную теплоту процессов. Конечные результаты представить в таблицу (таблица 3). Дать изображение процессов в p-V и T-S диаграммах.
Таблица 1
| Вариант 12 | |||||
| Состав газовой смеси, % объемные | t1, °C | ε=V2/V1 | |||
| N2 | H2 | CO2 | SO3 | ||
| 30 | 10 | 50 | 10 | 37 | 2,5 |
Таблица 2
| р1, МПа | n2 | n4 | n6 |
| 0,2 | 0,3 | 1,15 | 1,6 |
Варианты задачи: 34, 43, 52, 53, 64, 65.
ВУЗ: УГНТУ
Все задачи из: Термодинамика УГНТУ
3.55 Определить газовую постоянную и плотность газовой смеси, а также парциальные давления отдельных компонентов, если смесь состоит из 14% СО2, 73% N2, 6% О2 и 7% Н2О по объему. Абсолютное давление смеси равно р = 0,2 МПа, а температура t = 300ºС.
Скачать файл (банки РФ) 150 RUB3.56 Объемный состав горючего газа: φСО = 10 %; φH2 = 45 %; φСН4 = 35 %; φС2Н4 = 4 %; φСО2 = 3 %; φN2 = 3 %.
Определите молярную массу, плотность, удельный объем при нормальных условиях, удельную газовую постоянную R, парциальное давление метана в процентах и массовые доли содержания компонентов.
Ответ: Мсм = 12,61 кг/кмоль; ρсм.н = 0,563 кг/м³; υсм.н = 1,776 м³/кг; Rсм = 0,659 кДж/(кг·К); рСН4 = 35,0%; ωСО = 0,222; ωН2 = 0,072; ωС2Н4 = 0,089; ωСН4 = 0,445; ωN2 = 0,067; ωСО2 = 0,105.
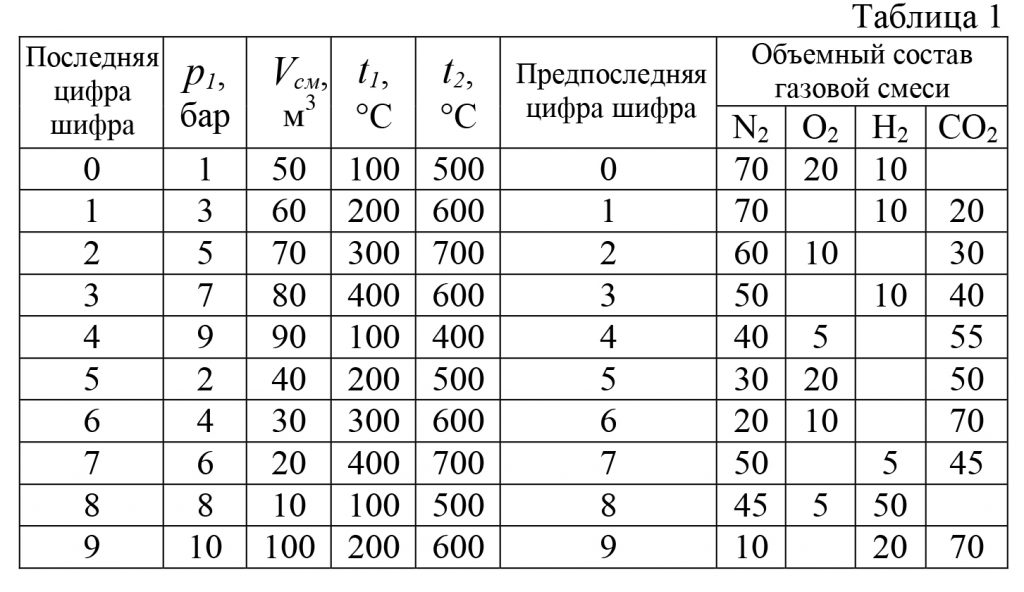
Скачать файл (банки РФ) 160 RUB3.57 Определить газовую постоянную, кажущуюся молекулярную массу, плотность и удельный объем при нормальных условиях для смеси идеальных газов, объемное содержание которых задано.
Найти также средние массовые теплоемкости этой смеси при постоянном давлении р1 в интервале температур от t1 до t2 и определить количество теплоты для изобарного нагревания m кг газовой смеси от t1 до t2, если задан общий начальный объем этой смеси Vсм.
Данные для расчета приведены в табл. 1.
Выбрать вариант задачи
ВУЗ: КНИТУ
3.58 Смесь, состоящая из М1 киломолей углекислого газа и М2 киломолей окиси углерода с начальными параметрами р1 = 5 МПа и Т1 = 2000 К, расширяется до конечного объема V2 = εV1. Расширение осуществляется по изотерме и по адиабате. Определить газовую постоянную смеси, её массу и начальный объем, конечные параметры смеси, работу расширения, теплоту процесса, изменение внутренней энергии, энтальпии и энтропии. Дать сводную таблицу результатов и анализ ее. Показать процессы в рV- и Ts- диаграммах.
Таблица 2
| Вариант 98 | ||
| М1 | М2 | ε = V2/V1 |
| кмоль | ||
| 0,9 | 0,1 | 16 |
Указание. Показатель адиабаты, а следовательно, и теплоемкости и следует принять не зависящими от температуры
Скачать файл (банки РФ) 300 RUB3.59 Анализ продуктов сгорания показал следующий объемный состав: СО2 – 12,3%, О2 – 7,2%, N2 – 80,5%. Определить среднюю (кажущуюся) молекулярную массу и массовый состав продуктов сгорания, а также удельный объем и плотность смеси при температуре t и давлении 100 кПа.
Таблица – ЧИСЛОВЫЕ ДАННЫЕ к задачам контрольной работы №1
| Предпоследняя цифра шифра | t, ºС |
| 0 | 750 |
ВУЗ: ОмГУПС
Все задачи из: Жданов Н.В. Термодинамика и теплопередача. ОмГУПС Омск 2013
3.60 Смесь идеальных газов задана объемными долями: rCO2 = 0,6, rN2 = 0,3, rO2 = 0,1. Общая масса смеси М = 20 кг. В начальном состоянии объем смеси V1 = 15 м³ и температура t1 = 47 ºС. В результате адиабатного сжатия давление смеси увеличивается до р2 = 0,9 МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ— и Ts – диаграммах.
Скачать файл (банки РФ) 200 RUB