Зайцев А.А. Проценко В.П. Юшков Ю.В. Техническая термодинамика Москва 1990
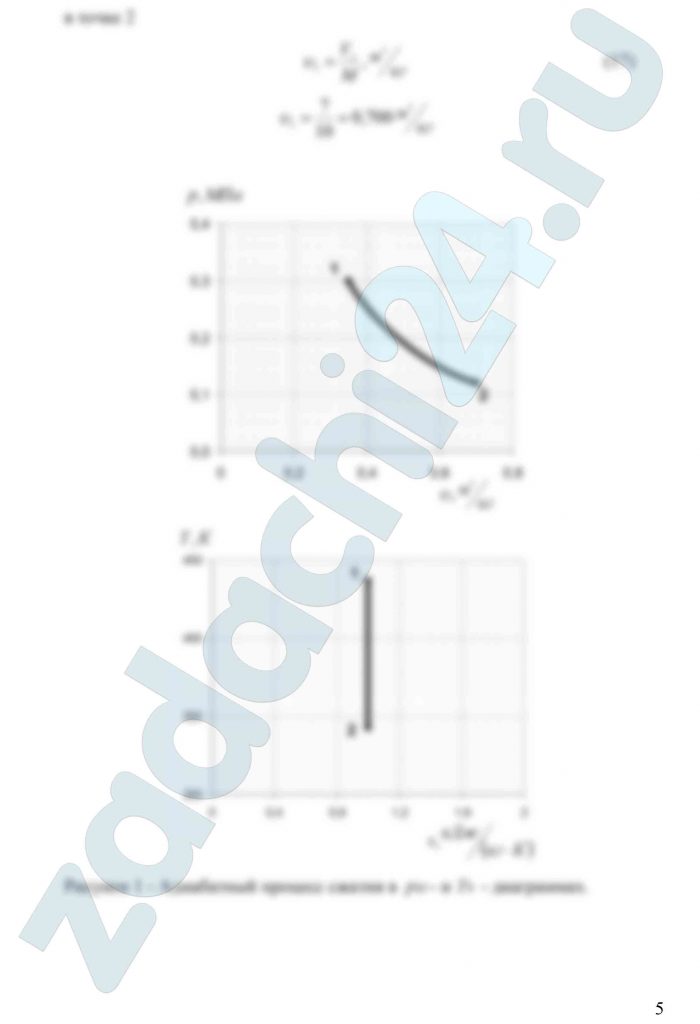
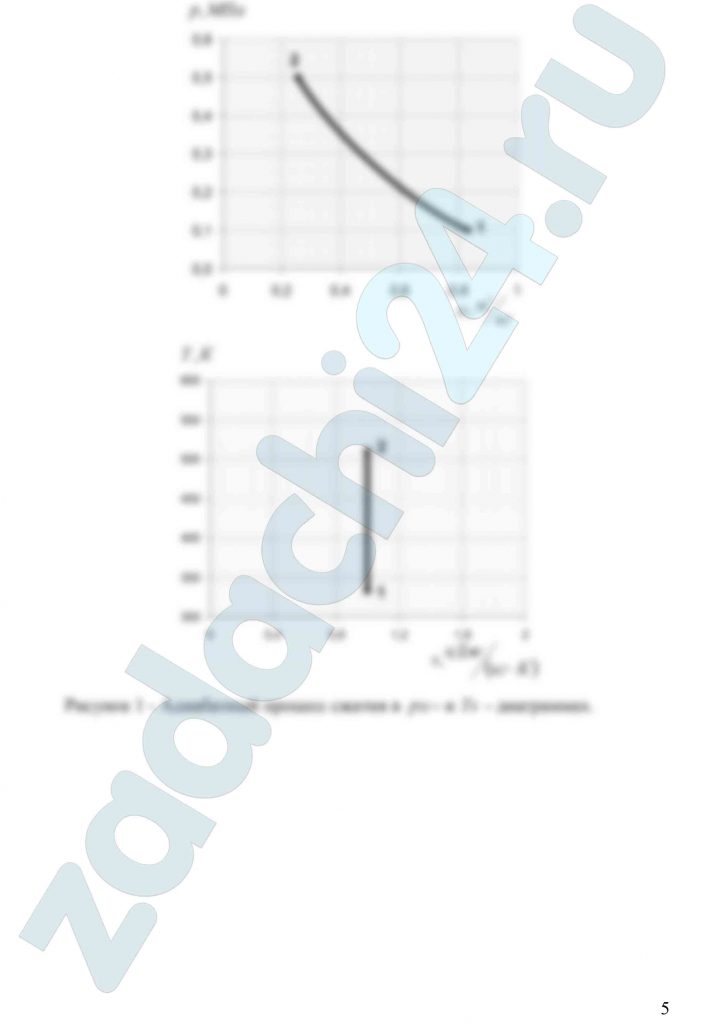
3.73 Смесь идеальных газов состоит из 8 кг СО2, 10 кг N2 и 2 кг О2. В начальном состоянии объем смеси V1 = 16 м³, а температура t1 = 57ºС. В результате адиабатного сжатия давление смеси возрастает до значения р2 = 0,6 МПа. Определить давление смеси в начальном состоянии, объем и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ- и Ts – диаграммах.
Скачать файл (банки РФ) 200 RUB3.60 Смесь идеальных газов задана объемными долями: rCO2 = 0,6, rN2 = 0,3, rO2 = 0,1. Общая масса смеси М = 20 кг. В начальном состоянии объем смеси V1 = 15 м³ и температура t1 = 47 ºС. В результате адиабатного сжатия давление смеси увеличивается до р2 = 0,9 МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ— и Ts – диаграммах.
Скачать файл (банки РФ) 200 RUB3.89 Смесь идеальных газов состоит из 30 кг СО2, 24 кг N2 и 6 кг О2. В начальном состоянии объем смеси V1=1,7 м³ и температура t1=330 °С. В результате адиабатного расширения температура газа уменьшается до t2=10 °С. Определить давление смеси в начальном состоянии, объем и давление в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ- и Ts-диаграммах.
Скачать файл (банки РФ) 200 RUB3.36 Смесь идеальных газов задана объемными долями: rCO2 = 0,3, rN2 = 0,25, rO2 = 0,45. Общая масса смеси М = 20 кг. Параметры смеси в начальном состоянии: р1 = 0,1 МПа t1 = 40 ºС. В результате адиабатного сжатия объем смеси уменьшается до значения V2 = 7 м³. Определить объем смеси в начальном состоянии, давление и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ— и Ts – диаграммах.
Скачать файл (банки РФ) 250 RUB)3.82 Смесь идеальных газов состоит из 15 кг СО2, 12 кг N2 и 3 кг О2. Объем смеси в начальном состоянии V1=20 м³, а давление р1=0,1 МПа. В результате адиабатного сжатия температура смеси возрастает до t2=327 ºC. Определить температуру смеси в начальном состоянии, объем и давление смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в pυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB3.65 Смесь идеальных газов состоит из 32 кг СО2, 40 кг N2 и 8 кг О2. В начальном состоянии параметры смеси р1=0,6 МПа и t1=370 ºC. В результате адиабатного расширения давление смеси уменьшается до р2=0,1 МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
Скачать файл (банки РФ) 200 RUB3.25 Смесь идеальных газов задана объемными долями: rO2 = 0,45, rCO2 = 0,30 и rN2 = 0,25. Общая масса смеси М = 10 кг. Объем смеси в начальном состоянии V1 = 3,5 м³, а давление р1 = 0,3 МПа. В результате адиабатного расширения объем смеси увеличился до значения V2 = 7 м³. Определить температуру смеси в начальном состоянии, давление и температуру смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Принять, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB3.83 Смесь идеальных газов задана объемными долями: rN2=0,6, rCO2=0,2 и rO2=0,2. Общая масса смеси М=10 кг. Объем смеси в начальном состоянии V1=4 м³, температура t1=387 ºC. В результате адиабатного расширения смеси ее давление уменьшается до значения р2=0,1 МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB3.27 Смесь идеальных газов состоит из 20 кг N2, 16 кг СО2 и 4 кг О2. Параметры смеси в начальном состоянии р1 = 0,1 МПа и t1 = 60ºС. В результате адиабатного сжатия давление смеси возрастает до значения р2 = 0,5 МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в — и — диаграммах.
Скачать файл (банки РФ) 250 RUB3.30 Смесь идеальных газов задана объемными долями: rCO2 = 0,4, rO2 = 0,35 и rN2 = 0,25. Общая масса смеси М = 10 кг. В начальном состоянии параметры смеси р1 = 0,9 МПа и t1 = 330ºС. В результате адиабатного расширения объем смеси увеличивается до значения V2 = 7,5 м³. Определить объем смеси в начальном состоянии, температуру и давление смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
Скачать файл (банки РФ) 250 RUB