3 Газовые смеси
3.21 Найти объемный состав смеси идеальных газов, заданный массовыми долями (см. задачу №2). Определить также парциальные давления компонентов смеси, если абсолютное давление смеси р.
Числовые данные к задачам 2.1. Термодинамика
| Предпоследняя цифра
учебного шифра |
Массовый состав смеси, % | р, МПа | |||
| СО2 | H2O | N2 | О2 | ||
| 1 | 18 | 1 | 65 | 16 | 0,1 |
Варианты задачи: 2, 3, 4, 5, 6, 7, 8, 9, 0.
ВУЗ: ТОГУ
Все задачи из: Гидравлика и теплотехника ТОГУ Хабаровск 2020
3.22 Газовая смесь содержит 10 кг кислорода (О2) и 15 кг азота (N2). Определить газовую постоянную смеси (R) и плотность (ρ) при нормальных условиях: р=769 мм рт.ст, t=0ºC.
3.23 Смесь, состоящая из М1 киломолей азота и М2 киломолей кислорода с начальными параметрами р1=1 МПа и Т1=1000 К, расширяется до давления р2. Расширение может осуществляться по изотерме, адиабате и политропе с показателем n. Определить газовую постоянную смеси, ее массу и начальный объем, конечные параметры смеси, работу расширения, теплоту, участвующую в процессе.
Дать сводную таблицу результатов и анализ ее. Показать процессы в pυ- и Ts — диаграммах. Данные необходимые для решения задачи, выбрать из табл.1.
Таблица 1
| Вариант | М1, кмоль | М1, кмоль | p2, МПа | n |
| 53 | 0,4 | 0,6 | 0,47 | 1,1 |
Указание. Показатель адиабаты, а следовательно, и теплоемкости cp, cυ следует принять постоянным, не зависящим от температуры.
3.24 Расчет термических и калорических параметров смеси идеальных газов
Смесь двух газов имеет температуру t=100 ºC, давление р=5 бар. Газы и исходные данные для расчета приведены в табл.4.2.1. Размерность данных в табл.4.2.1: n [кмоль], М [кг].
Определить массовые (g1, g2) и объемные (r1, r2) доли компонентов; мольную массу (μ), газовую постоянную (R) и плотность (ρ) газовой смеси; парциальные давления компонентов (p1, p2); калорические параметры газовой смеси (u, h, s); теплоемкость (cp,cυ) и показатель адиабаты (k) газовой смеси.
Результаты расчетов представьте в виде табл.4.2.2, 4.2.3.
Таблица 4.2.1 — Варианты задания газовой смеси
| Вариант | Газы | Исходные данные |
| 16 | CO2 CO | g2=0,4 |
Варианты задачи: 23.
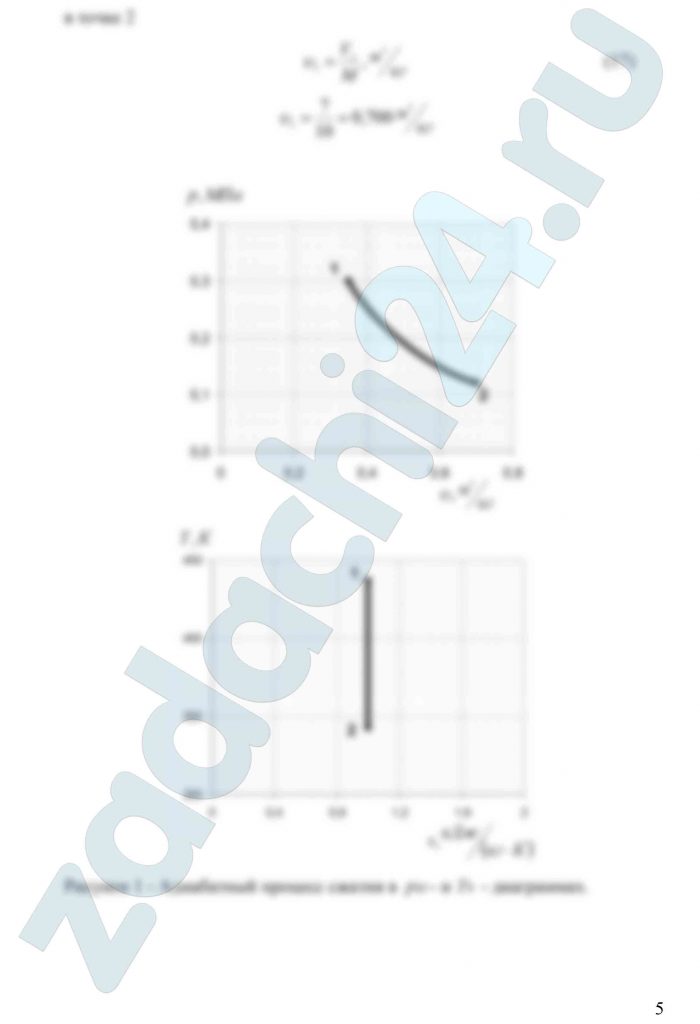
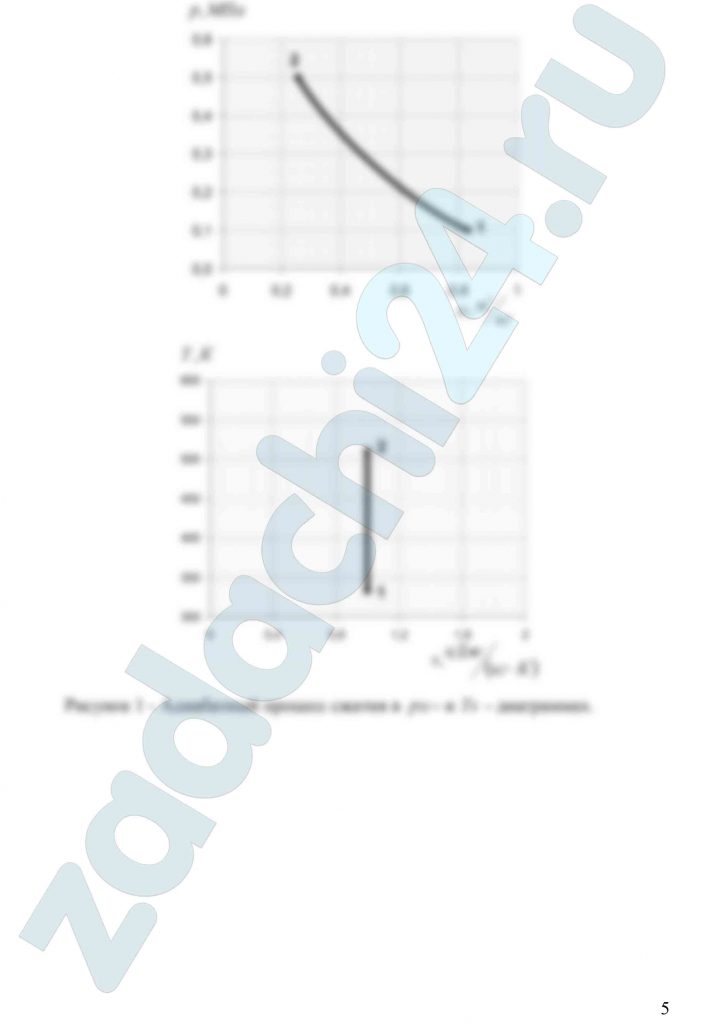
3.25 Смесь идеальных газов задана объемными долями: rO2 = 0,45, rCO2 = 0,30 и rN2 = 0,25. Общая масса смеси М = 10 кг. Объем смеси в начальном состоянии V1 = 3,5 м³, а давление р1 = 0,3 МПа. В результате адиабатного расширения объем смеси увеличился до значения V2 = 7 м³. Определить температуру смеси в начальном состоянии, давление и температуру смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Принять, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.
3.26 Требуется найти объемный состав смеси идеальных газов, заданный массовыми долями (см. задачу №2). Определить также парциальные давления компонентов смеси, если абсолютное давление смеси p.
Таблица 1 – Числовые данные к задачам контрольной работы №1
| Предпоследняя цифра
учебного шифра |
Массовый состав смеси, % | р, МПа | |||
| СО2 | H2O | N2 | О2 | ||
| 1 | 18 | 1 | 65 | 16 | 0,1 |
Варианты задачи: 2, 3, 4, 5, 6, 7, 8, 9, 0.
ВУЗ: МИИТ
3.27 Смесь идеальных газов состоит из 20 кг N2, 16 кг СО2 и 4 кг О2. Параметры смеси в начальном состоянии р1 = 0,1 МПа и t1 = 60ºС. В результате адиабатного сжатия давление смеси возрастает до значения р2 = 0,5 МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в — и — диаграммах.
3.28 Смесь идеальных газов заданного массового состава занимает объем V при постоянном абсолютном давлении p и температуре t. Требуется определить газовую постоянную смеси, среднюю молекулярную массу, массу смеси, объемный состав смеси, а также среднюю мольную, объемную и массовую теплоемкости смеси (при p=const) для интервала температур 0-t.
Таблица 2 – Числовые данные к задачам контрольной работы
| Предпоследняя цифра шифра 1 | ||||||
| Массовый состав смеси, % | V, м3 | р, МПа | t, ºC | |||
| CO2 | H2O | N2 | O2 | |||
| 18 | 1 | 65 | 16 | 2 | 1,0 | 200 |
Варианты задачи: 2, 3, 4, 5, 6, 7, 8, 9, 0.
ВУЗ: МИИТ
Все задачи из: Термодинамика и теплопередача МИИТ 2013
3.29 Найти удельный объем газовой смеси и парциальные давления ее составляющих, если объемный состав смеси следующий: СО2=15,6%, О2=8,7%, N2=75,7%, а общее давление ее р=0,1 МПа.
3.30 Смесь идеальных газов задана объемными долями: rCO2 = 0,4, rO2 = 0,35 и rN2 = 0,25. Общая масса смеси М = 10 кг. В начальном состоянии параметры смеси р1 = 0,9 МПа и t1 = 330ºС. В результате адиабатного расширения объем смеси увеличивается до значения V2 = 7,5 м³. Определить объем смеси в начальном состоянии, температуру и давление смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов на зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в рυ- и Ts — диаграммах.